
在过去数年中,我国医药行业发展迅速,已成为全球最大、最活跃的医药市场之一。为了进一步鼓励药品研发创新,近年来我国在医药行业启动了一系列药政和专利改革,包括药品专利权期限补偿的实施。本文对我国药品专利权期限补偿制度进行了全面的解析,并分析了该制度对创新药企业和仿制药企业的影响。
一、背 景
由于新药研发成本高、周期长、风险大,医药行业对专利保护的依赖性很强。如果没有专利保护,创新药企业很难收回研发成本并获得合理利润,从而影响其研发新药的积极性。然而,药品上市需要药品监管部门的严格审批,包括一系列研究,包括非临床安全性评价和临床试验等。这意味着即使专利申请获得批准,在获得上市批准之前,也要经过相当长的一段时间才能实施,导致专利保护期大大缩短。
专利保护期延长制度起源于美国1984年颁布的《药品价格竞争与专利期限补偿法案》,又称《Hatch-Waxman法案》[1]。随后,日本、韩国、欧盟、加拿大等多个国家或地区也相继建立了类似制度,以补偿创新药审批过程占用的时间导致的专利保护期损失。
我国近年来一直在探索专利保护期延长制度。2020年1月15日,我国与美国达成协议,同意根据《中华人民共和国政府和美利坚合众国政府经济贸易协议》[2]提供专利保护期延长制度,以补偿在专利授予或药品上市审批过程中的不合理延迟。2020年10月17日,第十三届全国人民代表大会常务委员会第二十二次会议通过了关于修改《中华人民共和国专利法》的决定[3]。自2021年6月1日起,新专利法生效,其中增加了关于药品专利权期限补偿的条款,标志着药品专利权期限补偿制度在我国正式实施。2024年1月20日,中华人民共和国国务院和中华人民共和国国家知识产权局分别发布了新专利法实施细则[4]和专利审查指南[5],进一步细化了药品专利权期限补偿在中国的实施。
二、药品专利权期限补偿概述
新《专利法》第42条第3款规定,为补偿新药上市审评审批占用的时间,对在中国获得上市许可的新药相关发明专利,国务院专利行政部门应专利权人的请求给予专利权期限补偿。补偿期限不得超过五年,新药批准上市后总有效专利期限不超过十四年。
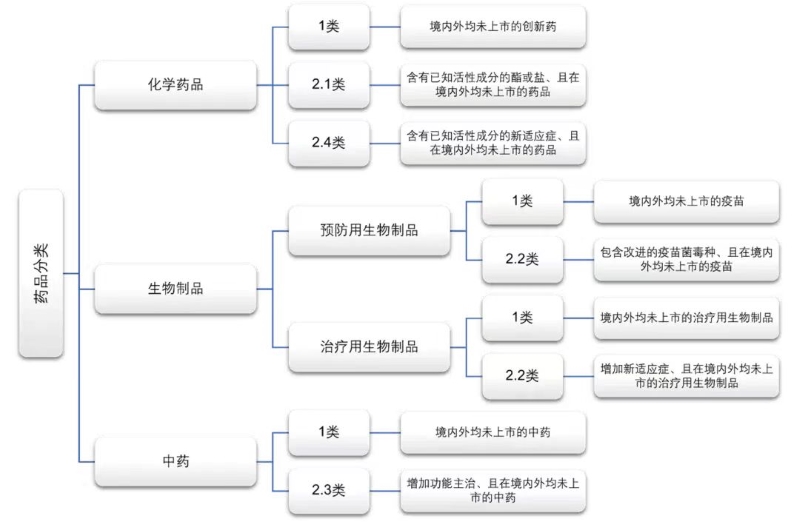
1. 适用药品专利权期限补偿的药品类型
药品专利权期限补偿适用于国务院药品监督管理部门批准上市的创新药和某些改良型新药。根据药品注册分类及申报资料要求[6],[7],[8]的规定,创新药应在境内外均未上市。这意味着该产品的新药上市申请至少应在其他国家批准该药物上市之前在中国提交。
• 适用药品专利权期限补偿的创新药:
根据我国现行药品注册分类的规定,创新药指1类药品,且在境内外均未上市。创新药包括以下尚未在境内或境外获批的药品:
(i)化学药品;
(ii)预防用生物制品-疫苗;
(iii)治疗用生物制品;
(iv)中药。
• 适用药品专利权期限补偿的改良型新药:
改良型新药也应在境内外均未上市,且根据药品注册分类的规定,仅限于以下药品:
• 化学药品第2.1类中对已知活性成份成酯,或者对已知活性成份成盐的药品;
• 化学药品第2.4类中含有已知活性成份的新适应症的药品;
• 预防用生物制品第2.2类中对疫苗菌毒种改进的疫苗;
• 治疗用生物制品第2.2类中增加新适应症的生物制品;和• 中药第2.3类,即增加功能主治的中药。
• 仿制药以及已在境外上市的药品不适用药品专利权期限补偿:
化学药品3类、4类和5类,预防用生物制品3类,以及治疗用生物制品3类,在中国提交上市申请时已在境内或境外上市,因此不适用药品专利权期限补偿。
适用药品专利权期限补偿的药品分类总结在下表中。
2. 提出药品专利权期限补偿请求的期限
专利权人应当自药品在中国获得上市许可之日起三个月内,经上市许可持有人授权,向专利局提出请求,并缴纳相应费用。
3. 获得药品专利权期限补偿的要求
• 请求补偿的专利授权公告日应当早于药品上市许可申请获得批准之日;
• 提出补偿请求时该专利有效;
• 该专利尚未获得过药品专利权期限补偿;
• 请求补偿专利的权利要求中包括了获得上市许可的新药相关技术方案,新药相关技术方案是指获批新药产品、获批的制备方法和获批的适应症;
• 如果一个药品涉及多项专利,专利权人只能请求对其中一项专利给予药品专利权期限补偿;
• 如果一项专利涉及多个药品,只能对一个药品就该专利提出药品专利权期限补偿请求。
4. 药品专利权期限补偿的计算
在确定药品专利权期限补偿时,应考虑该专利是否还提出过专利权期限补偿请求,并在专利权期限补偿请求的审批决定作出后再确定药品专利权期限补偿的时间。由于补偿原因不同,涉及专利权期限补偿和药品专利权期限补偿的期限可以累计,但仍然应满足总有效专利权期限自药品上市许可申请批准后不超过14年的规定。
补偿期限的计算方法是将专利申请日与在中国获得上市许可之日的间隔天数减去五年。同时,补偿期限应满足以下两个要求:补偿期限不超过5年,且该药品上市许可申请批准后总有效专利权期限不超过14年。
以下线图和公式显示了补偿期限需要满足的条件。

PTE = (在中国获得上市许可的日期 – 专利申请日) – 5年 (应≦5年)
药品获得上市许可后专利总有效期限 = (20年专利权届满日 - 在中国获得上市许可的日期) + 专利权补偿期限(如果适用) + 药品专利权补偿期限 (应≦14年)
5. 药品专利权期限补偿请求的审查
经审查后认为专利权期限补偿请求不符合期限补偿条件的,专利局将给予专利权人至少一次陈述意见或修改的机会。如果专利权期限补偿请求符合期限补偿条件的,专利局应当作出给予期限补偿的决定,告知期限补偿的天数,并在专利公报中公布药品名称、经批准的适应症、原专利权期限届满日和现专利权期限届满日等信息。
专利权人、因相关专利存在侵权纠纷或者利害关系人对国家知识产权局作出的关于是否给予专利权期限补偿的决定不服的,可以向国家知识产权局申请行政复议。
6. 药品专利权期限补偿期间的保护范围
由于药品专利权期限补偿的目的是弥补新药上市审批的时间,因此已获得上市许可的新药与请求药品专利权期限补偿的药品专利的技术方案应直接关联。
获得药品专利权期限补偿的专利技术方案的保护范围通常小于该专利的原始保护范围,并仅限于对应已获批适应症的新药。这意味着对于产品权利要求,获得药品专利权期限补偿的专利技术方案的保护范围限于用于获批适应症的新药产品;对于用途权利要求,获得药品专利权期限补偿的专利技术方案的保护范围限于新药产品已获批的适应症;以及对于方法权利要求,获得药品专利权期限补偿的专利技术方案的保护范围限于用于经批准的适应症的上市新药产品在国务院药品监督管理部门备案的生产工艺。
因此,专利权人在提出PTE请求时,应当提供确定PTE保护范围的证明材料,例如显示获批新药的成分的证明材料、显示新药的获批适应症的证明材料、显示药品监督管理部门批准的新药生产工艺的材料等。
三、思 考
对于创新药企业而言,从发现“苗头”化合物,到先导化合物的优化,再到候选药物的临床前和临床试验,直至上市,是一个漫长的过程,因此专利申请往往在药品上市前很久就已提交。药品专利权期限补偿在中国的实施对创新药企业具有积极作用,因为如果药品专利权期限补偿请求获得批准,就可以延长创新药企业的专利保护期限。在药品专利权期限补偿制度下,创新药企业的合法权益能够得到加强保护,激励新药研发的持续创新。
因此,创新药企业应积极利用药品专利权期限补偿寻求专利保护期限的延长。创新药企业在提出药品专利权期限补偿请求时,应综合考虑权利要求类型、权利要求范围、专利稳定性、专利实施、药品专利权期限补偿适用的范围、每药每专利只能提出一次药品专利权期限补偿请求的规则等因素,以最大程度合理地延长一项或多项专利的专利权期限。例如,专利权人可以选择一项专利就新药及其获批适应症提出药品专利权期限补偿请求,然后再选择另一项专利就其新获批适应症提出药品专利权期限补偿请求。因此,专利申请策略也可能需要根据新药申请的扩展,例如适应症扩展等进行调整。
如前所述,在中国提出药品上市许可申请时已在境外上市的药品,包括化学药品5.1类、预防用生物制品3.1和3.2类以及治疗用生物制品3.1和3.2类,不符合药品专利权期限补偿的条件。因此,创新药企业应考虑在新药在其他国家上市之前在中国提交新药申请。
对于仿制药企业而言,延长创新药的专利期限必然会延缓仿制药的上市时间,对国内众多的仿制药企业造成较大影响。仿制药企业应密切关注创新药企业的专利期限,关注是否已获得药品专利权期限补偿、是否可以挑战国家知识产权局对药品专利权期限补偿的决定,并策略性地布局简化新药申请(ANDA)的进程。必要时,仿制药企业也可考虑对创新药企业的专利提起无效宣告请求。
由于药品专利权期限补偿带来的仿制药上市时间延缓,可能会增加国内患者的医药费用支出。因此,寻求创新药企业与仿制药企业的利益平衡具有重要意义。在制定与药品专利权期限补偿相关的专利法和实施条例时,也考虑到了这一点。例如,对于提出药品专利权期限补偿请求需要满足的条件,只有未获得过药品专利权期限补偿的专利才满足该条件;如果药品受多项专利保护,则只能延长一项专利的期限;若一项专利涵盖多个药品,则该专利只能针对一个药品提出药品专利权期限补偿请求。此外,还规定了药品专利权期限补偿的最长期限为5年,且药品批准上市后总专利有效期限不得超过14年。这些要求不仅有效避免了创新药企专利期限的重复补偿,也防止了专利期限的过度延长。
参考文献
[1] https://www.uspto.gov/patents/laws/patent-terms-extended,Patent Term Extension (PTE) Under 35 U.S.C. 156。
[2] 中华人民共和国政府和美利坚合众国政府经济贸易协议。
[3] 全国人民代表大会常务委员会关于修改《中华人民共和国专利法》的决定。
[4] 中华人民共和国国务院令第769号。
[5] 国家知识产权局令第78号。
[6] 国家药监局关于发布生物制品注册分类及申报资料要求的通告(2020年第43号)。
[7] 国家药监局关于发布化学药品注册分类及申报资料要求的通告(2020年第44号)。
[8] 国家药监局关于发布《中药注册分类及申报资料要求》的通告(2020年第68号)。
[9] 国家知识产权局关于专利权期限补偿和专利开放许可相关行政复议事项的公告(第560号)。